こんにちは。放射線などについて分かりやすく解説している大地(だいち)です。
今日は、
・「同位体」「放射性同位体」とは何ですか?
・(放射性)同位体にはどのような事例がありますか?
こういった疑問に答えます。
○本記事の内容
- (似て非なるものです)放射性同位体について
- 同位体とは
- 放射性同位体とは
- (放射性)同位体の例
- 水素
- 炭素
- まとめ
この記事を書いている私は、2011年の福島第一原子力発電所の事故の後、除染や中間貯蔵施設の管理など、継続して放射線の分野での業務に従事してきました。
その間、働きながら大学院に通い(いわゆる社会人ドクター)、放射線の分野で博士号を取得しました。
こういった私が、解説していきます。
(似て非なるものです)放射性同位体について
放射性同位体とは、一言でいうと、放射能を持つ同位体のことです。
それでは同位体とは何でしょうか。
もう少し詳しく見てみましょう。
同位体とは

同位体とは、同じ陽子数を持ちながら、違う中性子数を持つ元素同士の関係や、それぞれの核種のことを指し、アイソトープとも呼ばれます(例:「AはBの同位体です。」「AとBは同位体の関係にあります」)。
こちらの記事でも解説しましたが、陽子数が元素の種類を決めますし、陽子数と中性子数を足したものが質量数ですので、例えば、「同じ元素だが、違う質量数を持つ元素同士の関係や、それぞれの核種」などと言い換えることもできます。
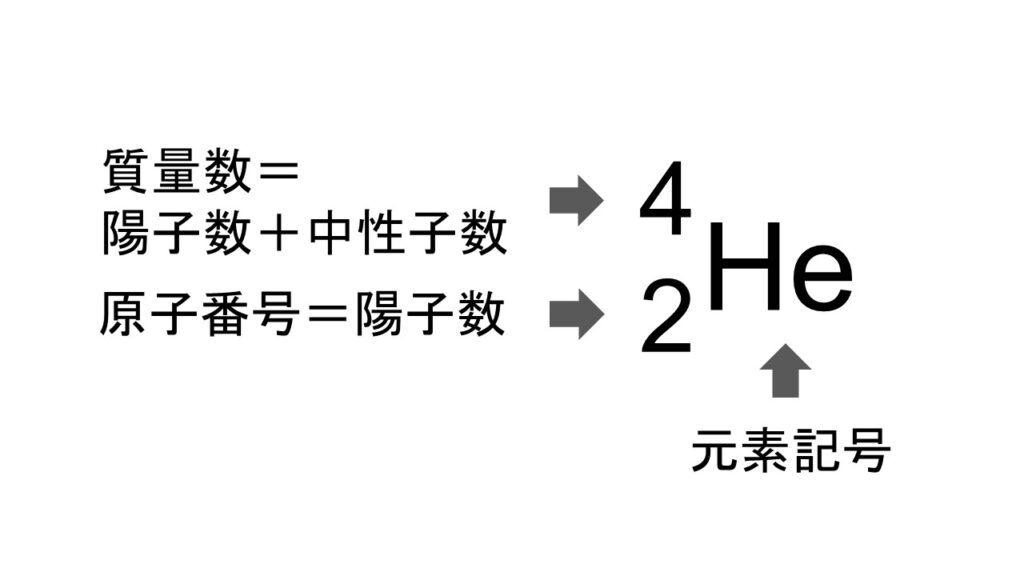
ちなみに、元素の状態を一目で表現するために、陽子数及び質量数については、以下のように書くことがあります。
これはこちらの記事でも登場したヘリウム原子の例ですが、元素記号の左上に質量数(=陽子数+中性子数)を書き、左下に原子番号(=陽子数)を書きます。
中性子数は左上の数値から左下の数値を引くことで計算できる(この例の場合、4-2=2)、ということです。
具体的な同位体の種類については、以下の章でより詳細に解説したいと思います。
放射性同位体とは
先ほども説明したように、放射性同位体は、放射能を持つ同位体のことで、ラジオアイソトープとも呼ばれます(放射能などについては、こちらの記事をご覧ください)。
同位体とは、先ほども説明したとおり、同じ陽子数を持ちながら、違う中性子数を持つ核種などのことですが、同位体の中には、中性子数が違うことで、原子全体が不安定となった結果、放射性壊変により放射線を放出するものがあり、これらを放射性同位体と呼ぶ、ということです。
(放射性)同位体の例
それでは、同位体や放射性同位体の具体的な例を見てみましょう。
水素

同位体や放射性同位体の具体的な例の一つが水素です。
下の図にも示したとおり、水素の陽子数は1で、水分子を構成する水素原子などにおいて、環境中に存在する割合が最も高いのが、中性子を持たない水素原子です(次に示す重水素と区別するために「軽水素」と呼ばれることもあります)。
そして、水素には、中性子を一つ持つ、つまり、質量数が2である重水素(デューテリウム)と呼ばれる同位体があります。
重水素は原子核反応での中性子の減速剤として使用されているほか、核融合の燃料としての活用も期待されています。
更に、中性子を二つ持つ、つまり、質量数が3である三重水素(トリチウム)もあり、この三重水素は、放射能を有している放射性同位体です。
自然界にもごくわずかに存在していますが、原子力発電所などの原子炉関連施設から計画的に放出される放射性物質として知っている方も多いかと思います。

水素には、更に四重(質量数:4)から八重(質量数:8)までの同位体がありますが、いずれも人工的に合成された同位体であり、物理学的半減期も非常に短いため、ここでの説明は割愛します。
炭素

同位体の例は非常にたくさんありますが、ここでは、炭素を紹介しておきます。
炭素にも、水素と同様、たくさんの同位体があり、具体的には、「炭素8(質量数:8)」から「炭素22(質量数:22)」までありますが、今回は、その内の代表的な例である、「炭素12」「炭素13」「炭素14」を紹介しておきます。
自然界に存在する炭素はほとんどが炭素12ですが、わずかに炭素13が存在し、炭素14も更に少ない割合で存在しています。
それ以外の炭素はすべて人工的に合成して得られる同位体で、かつ、物理学的半減期も非常に短い核種です。
ちなみに、炭素の陽子数は6なので、「炭素12」「炭素13」「炭素14」の中性子数はそれぞれ6、7、8となり、このうち、炭素14が放射能を持つ放射性同位体です。

この炭素14は、放射性炭素年代測定という手法を用いて、動植物がいつ頃存在していたかと推定する際に分析対象となる放射性核種です。
ごく簡単に説明すると、動物も植物も、生きている間は、食物などを通じて供給される炭素により、炭素14の存在比率もほぼ一定に保たれますが、その死後は炭素の供給が止まるため、炭素14の存在比率も低下していきます。
つまり、現時点での炭素14の存在比率を分析することで、いつその動植物が存在していたかと推定するための手掛かりになる、ということです。

この手法は、考古学の分野では、動植物の生存時期を分析したり、芸術の分野では、絵画の作成時期を分析したり(例:キャンバスに含まれる植物などを分析)するために用いられています。
まとめ
今回は、同位体及び放射性同位体について説明しました。
同位体とは、同じ陽子数を持ちながら、違う中性子数を持つ元素同士の関係や、それぞれの核種のこと、そして、放射性同位体は、放射能を持つ同位体のことです。
また、具体例として、水素と炭素の同位体及び放射性同位体について説明し、考古学や芸術の分野での実際の活用例も示しました。
ちなみに、以上とほぼ同じ内容を動画にもまとめてみましたので、よろしければご覧ください。
ちなみに、以上の解説とほぼ同じ内容を動画にもまとめてみましたので、よろしければご覧ください。
日本語版
さらに、3分や1分以内で簡単にまとめた動画も作成しましたので、よろしければこちらもご覧ください。
(3分動画)
(1分動画)
英語版
英語版についても、3分や1分以内で簡単にまとめた動画も作成しましたので、よろしければこちらもご覧ください。
(3分動画)
(1分動画)
ドイツ語版
3分や1分以内の簡易版のみですが、ドイツ語でも動画を作成しましたので、よろしければこちらもご覧ください。
(3分動画)
(1分動画)
フランス語版
1分以内の簡易版のみですが、フランス語でも動画を作成しましたので、よろしければこちらもご覧ください。
本記事の英語版はこちらからご覧いただけます。
今回は以上となります。
ご覧いただき、ありがとうございました。



コメント